fMOST助力暨南大学陈功团队利用基因疗法改善AD小鼠认知功能
2025-02-26
前言
骆清铭院士和龚辉教授带领MOST团队发明的显微光学切片断层成像系列技术(MOST/fMOST)作为介观尺度最精准的三维完整器官成像技术,已在神经机制、脑疾病、心脑血管疾病以及药理毒理等科学前沿领域研究中发挥重要作用,并带动了相关标记技术和大数据处理和解析技术的发展。

文章题目:Brain-Wide Neuroregenerative Gene Therapy Improves Cognition in a Mouse Model of Alzheimer’s Disease
发表时间:2025年2月14日
发表期刊:Advanced Science
研究团队:暨南大学陈功团队
阿尔茨海默病(Alzheimer’s disease,AD)是一种极具破坏性的神经退行性疾病,其病理特征包括Aβ斑块和tau蛋白神经原纤维缠结的沉积,引发神经炎症、氧化应激,进而神经元和突触连接受损,导致患者认知功能下降。现有的治疗主要通过在疾病早期减少Aβ蛋白,延缓疾病早期进展,但对中重度患者的认知改善效果甚微,这主要是因为已丢失的神经元无法被补充。因此,寻找能再生神经元的替代疗法,对逆转AD患者的记忆缺陷至关重要。
2025年2月14日,暨南大学陈功团队在Advanced Science上发表了题为 “Brain-Wide Neuroregenerative Gene Therapy Improves Cognition in a Mouse Model of Alzheimer’s Disease”的研究性论文。本研究开发了一种全脑神经再生基因疗法,并揭示了其在改善AD小鼠认知功能方面的重要作用及其机制。作者利用可高效穿越血脑屏障的腺相关病毒载体,将NeuroD1基因导入AD小鼠模型大脑,实现全脑范围内将内源性星形胶质细胞转化为功能性神经元。大脑皮层和海马中约50万新生神经元广泛分布,并整合到已有神经网络,显著改善AD小鼠认知功能,为AD等神经退行性疾病的治疗提供了新策略。
1海马局部神经再生
海马在学习和记忆中意义重大,在AD患者海马发生显著的神经元丢失。课题组前期研究发现,NeuroD1可以将5xFAD小鼠脑皮质反应性星形胶质细胞重新转化为功能性神经元。因此,作者将AAV9-GFAP-NeuroD1病毒注入5xFAD小鼠海马脑区,评估 NeuroD1介导的AtN(Astrocyte-to-neuron)转化在海马脑区中的潜力。结果发现,1周后,GFAP+星形胶质细胞开始表达NeuroD1;3周和6周时,NeuroD1+的星形胶质细胞显著表达神经元标志物NeuN。这表明在5xFAD小鼠海马中,NeuroD1成功介导了星形胶质细胞向神经元的转化,实现了局部神经再生。
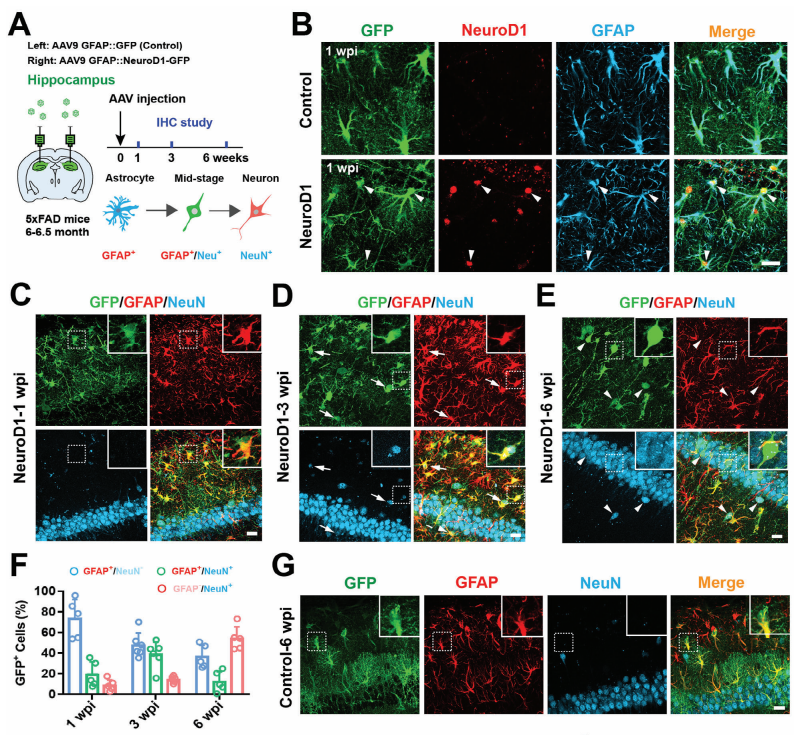
Figure 1:5xFAD小鼠海马中NeuroD1介导的局部AtN转换
2AtN转化的分子机制解析
进一步分析发现,存在星形胶质细胞亚群5在NeuroD1干预下,成熟星形胶质细胞基因下调,未成熟星形胶质细胞和神经元基因上调。拟时序分析显示,星形胶质细胞受NeuroD1作用沿分化路径向神经元发展。RNA速率分析发现,亚群5可能是AtN转化的主要来源。此外,AtN转化还伴随着能量代谢偏好的改变,从依赖糖酵解转向氧化磷酸化。这一系列结果共同揭示了NeuroD1驱动AtN转化的分子机制。
3全脑基因治疗实现AtN转化
以往的研究表明,AD患者大脑多个区域存在神经元丢失。因此,作者利用AAV-PHP.eB,探究全脑AtN转化的可能性。结果发现GFP在全脑广泛表达,且大部分为星形胶质细胞。
星形胶质细胞具有区域特异性,为明确NeuroD1是否可以实现不同脑区的神经元转化,对眼眶后注射(R.O.)AAV-PhP.eB-NeuroD1-GFP的小鼠进行免疫组化分析,表达60天时皮层和海马中GFP+细胞呈现典型神经元形态并表达NeuN。但不同脑区转化效率不同,皮层、海马和部分中脑区域转化效率较高,而嗅球、纹状体、丘脑和后脑等区域较低。这表明通过全脑基因治疗可实现AtN转化,但存在区域特异性。
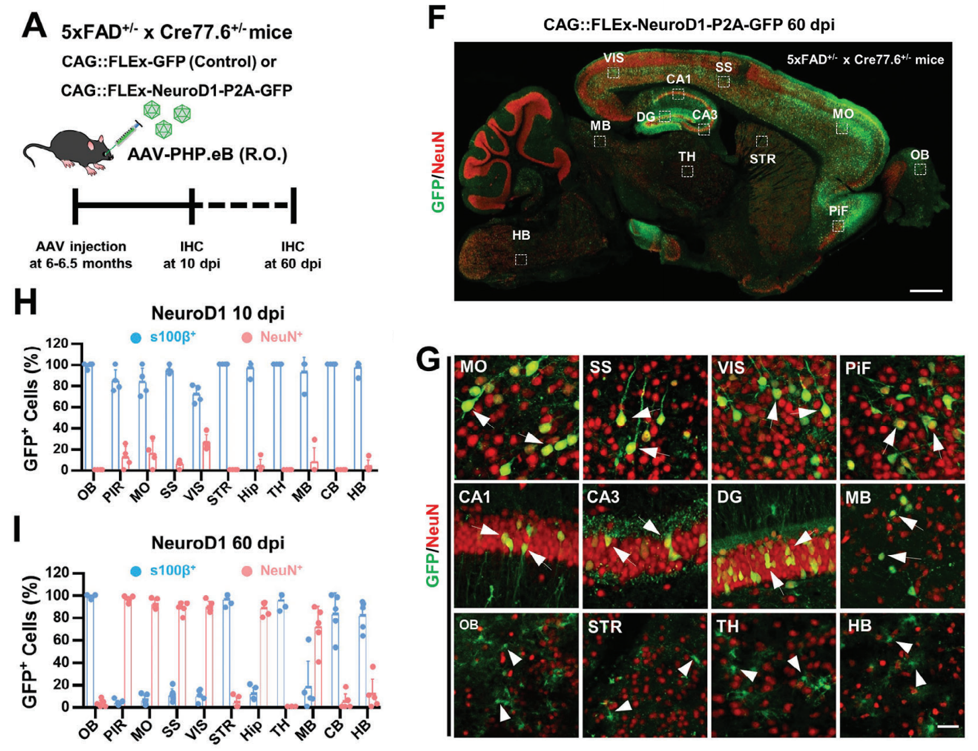
Figure 4:5xFAD小鼠的全脑AtN转换
4 新神经元的数量、功能与特性
作者进一步探究了全脑AtN转换可以在AD小鼠脑中再生神经元的数量。为此,作者通过荧光显微光学切片断层扫描-fMOST技术对全脑进行成像,发现NeuroD1介导的全脑基因治疗在AD小鼠大脑皮层和海马体分别再生约36.6万个和14.9万个新神经元,总计超50万个。
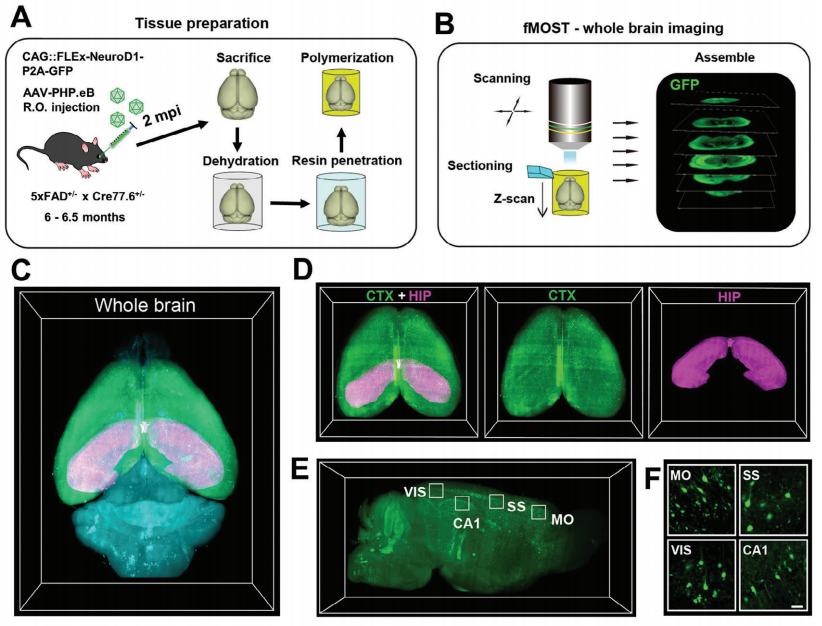
Figure 5:AtN转化的fMOST全脑成像
对新生神经元进行电生理记录发现,神经元能产生重复动作电位和自发突触电流,证明新神经元已整合到功能性神经回路中。此外,转化神经元主要为谷氨酸能神经元,但并未破坏海马脑区的兴奋-抑制平衡。同时,转化神经元能向合适的脑区投射轴突,如皮层深层转化神经元向脑桥基底核(Basal pontine nucleus,BPN)投射,海马转化神经元向对侧海马投射。
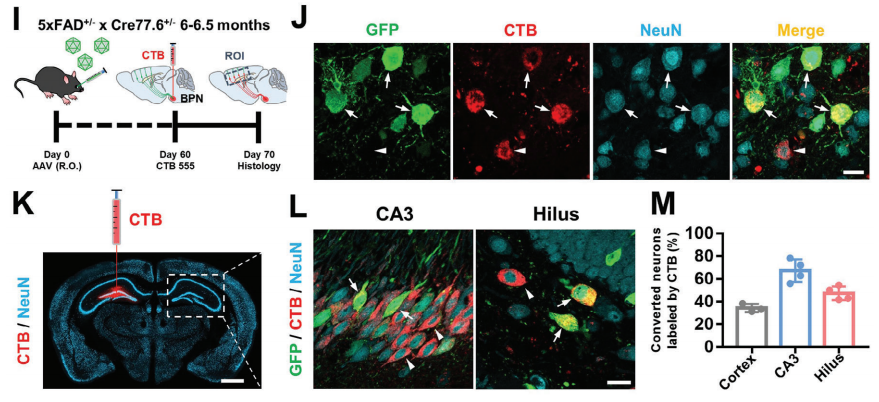
Figure 6:星形胶质细胞转化神经元的轴突投射
5认知功能显著改善
6转化神经元对认知改善的关键作用
最后,作者利用化学遗传进一步验证。结果发现,给予CNO抑制转化神经元活性后,原本经NeuroD1治疗改善的恐惧记忆受到抑制,小鼠的恐惧记忆水平与未治疗组相似。这充分证明了星形胶质细胞转化的神经元对5xFAD小鼠恐惧记忆的改善起着关键作用。
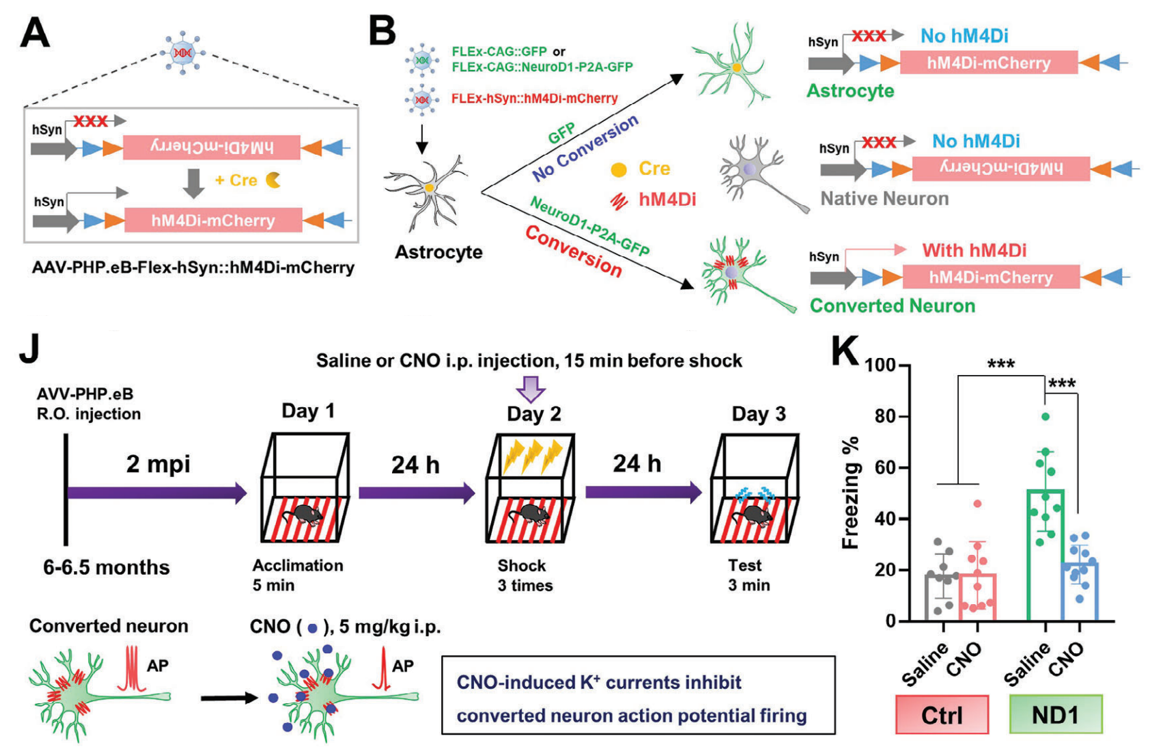
Figure 8:星形胶质细胞转化的神经元有助于改善5xFAD小鼠的记忆
综上所述,AD作为一种不可逆的脑部疾病,现有治疗手段难以解决神经元丢失和神经回路修复问题。本研究利用能穿透血脑屏障的AAV-PhP.eB病毒载体,将NeuroD1介导的AtN系统经全身给药,在5xFAD小鼠多个脑区,特别是与学习记忆高度相关的皮层和海马体,实现了超50万个新神经元在大脑皮层和海马再生并融入神经回路。功能层面,转化后的神经元能定位到正确位置,并形成长轴突投射;抑制转化神经元的活性会阻碍认知功能的改善。总的来说,本研究首次证实,全脑AtN转化基因疗法可显著改善5xFAD小鼠的认知功能,为AD治疗提供了一种全脑神经再生的基因治疗策略。
在该研究过程中,fMOST技术通过对全脑基因治疗的5xFAD小鼠大脑样本进行高分辨率成像,精确识别和统计了大脑皮层和海马中的新生神经元数量。这一功能为研究全脑基因治疗转化效果提供了关键数据支持,凸显了fMOST在神经科学研究中的重要价值。
[1] Gong Chen et al.“Brain-Wide Neuroregenerative Gene Therapy Improves
Cognition in a Mouse Model of Alzheimer’s Disease.” Advanced Science. 14 Feb. (2025)
2025
/
02-26
所属分类:
学术进展
相关资讯—

