Array-fMOST高通量单细胞水平全器官三维成像
2023-02-16
骆清铭院士和龚辉教授带领MOST团队发明的显微光学切片断层成像系列技术(MOST/fMOST)作为介观尺度最精细的三维成像技术,伴随着各种标记技术和数据处理技术的发展,现已在神经机制研究、脑疾病研究、心血管疾病研究以及病理毒理等领域得到广泛应用。
作为最复杂的器官之一,大脑拥有亿万级数量的神经元、胶质细胞等各种类型的细胞。这些细胞处在错综繁杂的连接网络中。介观水平全器官三维成像技术帮助我们更好地研究细胞的生理和病理表型,然而常见的成像方法通常步骤繁琐且通量较低。
今年2月3日,MOST团队在国际期刊communications biology上发表了题为Three-dimensional mapping in multi-samples with large-scale imaging and multiplexed post staining的文章。该研究建立了一套称为Array-fMOST的高通量单细胞水平全器官三维成像系统,可以在15天内完成32个小鼠脑同步成像(分辨率0.65μmx0.65μmx0.3μm)。基于这套系统,作者对阿尔茨海默症、自闭症、自然衰老等多种模型进行成像,并将该技术应用于多样本细胞定位、分子表型鉴定、细胞构筑、神经投射等研究。

Array-fMOST全流程包括多样本包埋、高分辨双色成像、数据配准和分析。成像包含两种模式:连续成像和间隔成像。连续成像获取连续三维数据集,保证自动配准特性,适合于神经环路示踪和单神经元形态分析;间隔成像不仅可以定位全脑细胞分布,还可以将完整切片收集起来,以用于后续蛋白表型鉴定、病理染色等实验。
相比于单个样本逐一成像,Array-fMOST在样本制备、成像扫描、组织切片和成像系统调整方面节省了大量时间。同时,由于这些样本是同步成像的,图像冗余度、强度校正参数等用于数据处理的关键参数可以重复用于所有样本,因此也减少了数据处理时间。
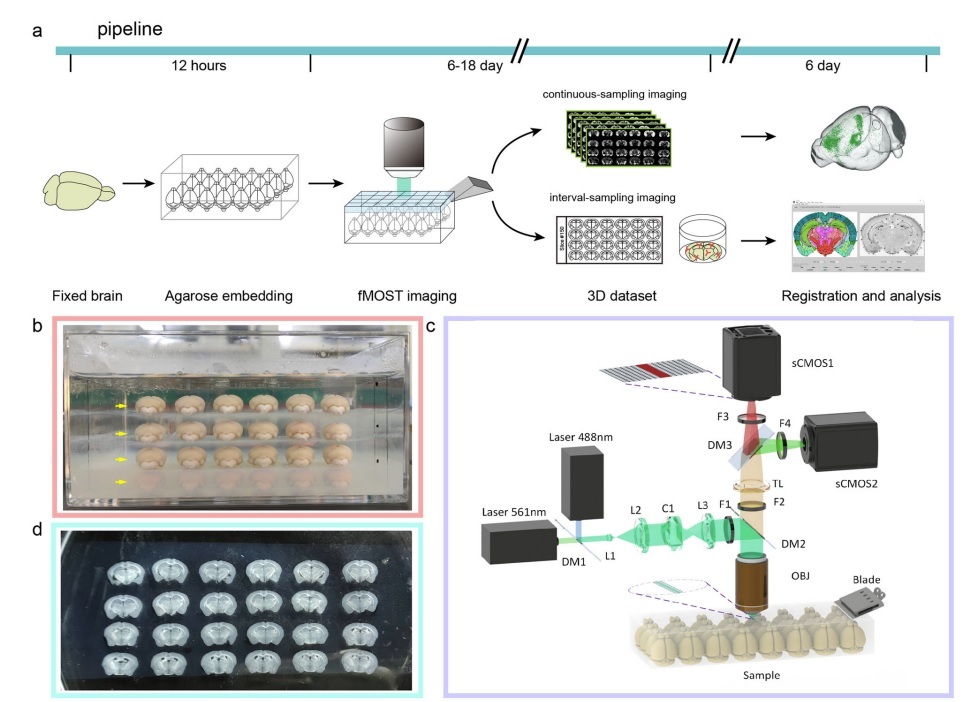
图1. Array-fMOST全流程示意图
研究人员对Thy1-YFP H-line和Thy1-EGFP M-line小鼠脑进行Array-fMOST成像,发现Thy1-YFP H-line小鼠具有更强的荧光信号,这表明Array-fMOST系统能很好的对比不同样本在相同成像条件下的荧光强度差异。

图2. 不同品系小鼠脑荧光信号差异性
随后,作者结合转基因技术和荧光染料灌注血管标记技术,探索AD模型小鼠皮层中生长激素抑制素表达阳性细胞(SOM+)的空间表达以及血管的形态特征。利用Array-fMOST系统直观地看到不同类型样本间的形态差异:显然,相比于对照组,模型组的SOM+细胞形态发生异常,血管空间密度降低。
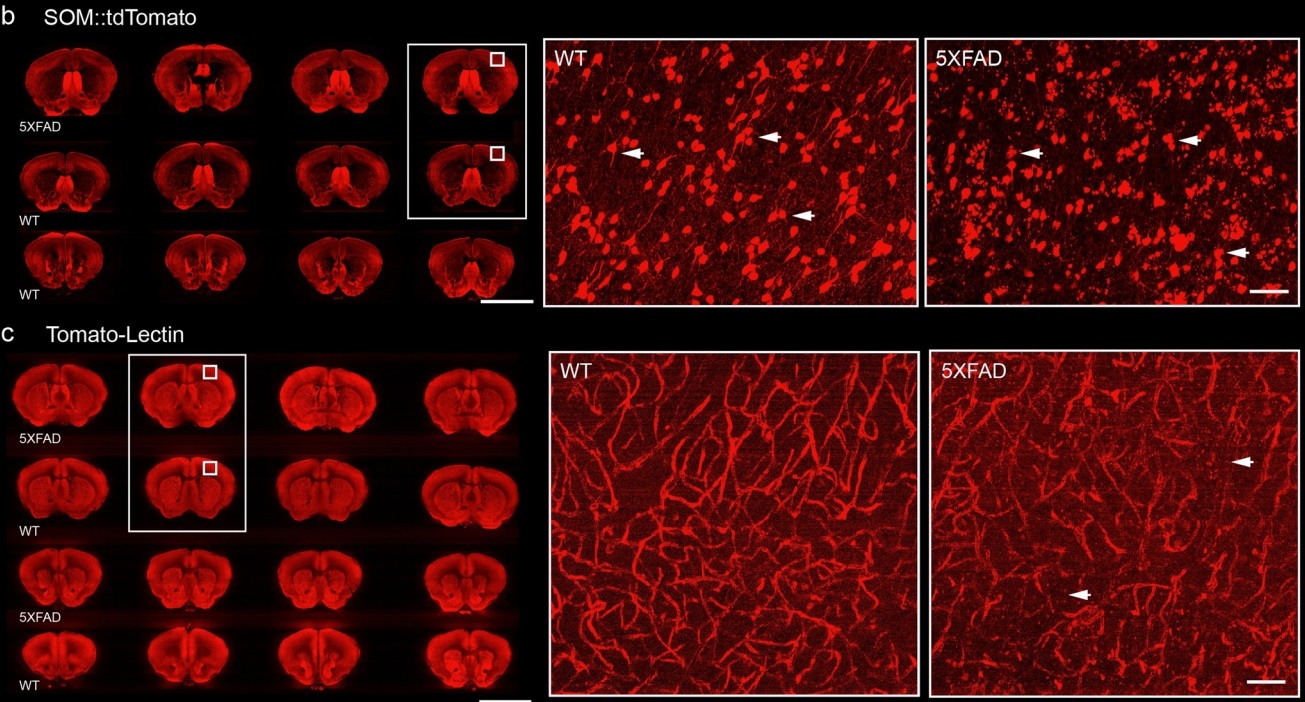
图3. AD模型小鼠SOM+细胞形态变化和血管密度变化
通过Array-fMOST的间隔成像模式收集连续切片,可以方便的与免疫荧光等技术联用,在单细胞分辨率下,从多个样本中筛选病理差异性。研究者对14周龄自然衰老小鼠(相当于人类45-50岁)和3周龄的对照组小鼠SOM+细胞和神经微环境变化进行定量分析。正如以往研究所示,衰老小鼠听觉皮层的SOM+细胞数量减少,而机制仍不清楚。为探究细胞丢失的机制,作者收集连续切片并进行免疫荧光染色,对比3周龄小鼠,14周龄小鼠听觉皮层SOM表达下调,而GFAP、PDGFRβ表达上调,这揭示了自然衰老过程中细胞丢失的空间分布模式。
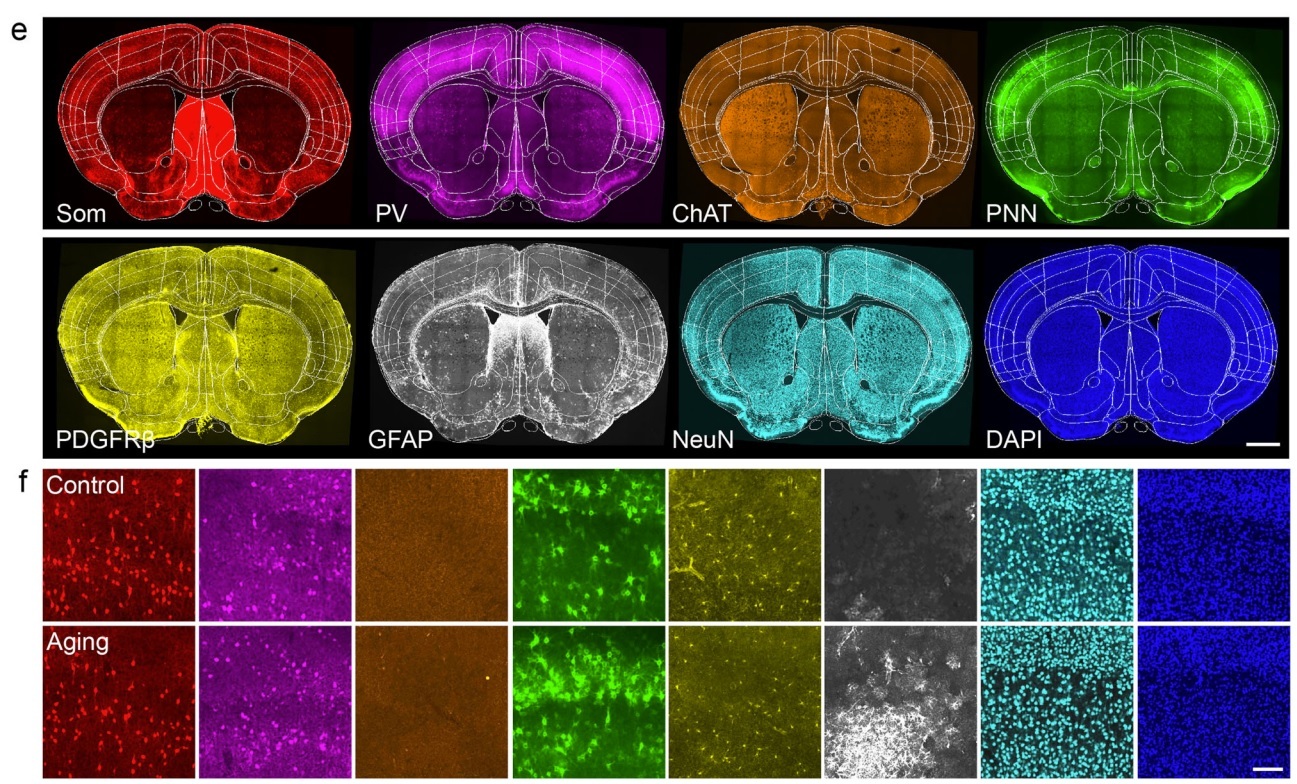
图4. 自然衰老小鼠蛋白分子表型鉴定
利用RV逆行跨单极标记技术结合Array-fMOST获取AD小鼠、自闭症小鼠和正常小鼠的内侧前额叶皮层(mPFC)中GABA能神经元输入环路。可见疾病模型中,部分脑区的输入神经元显著减少。
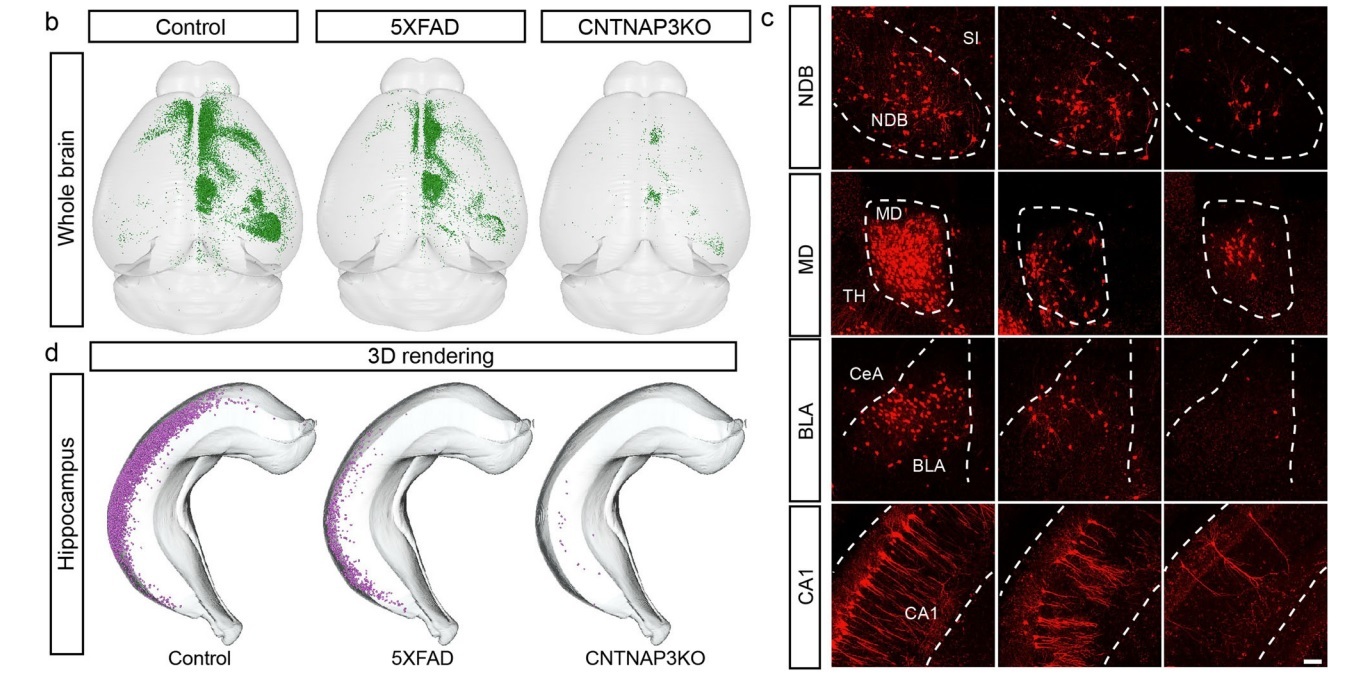
图5. AD小鼠和自闭症小鼠mPFC神经元逆行投射全脑精确定量分析
以上研究数据证明了该技术的便捷性、可扩展性和广泛的适用性。Array-fMOST系统最大的优势之处在于可以同时对多个样本成像,快速对比不同样本间的差异,为研究疾病的发病机制和进展提供了新的研究手段。
参考文献
Chen S, Liu G, Li A, et al. Three-dimensional mapping in multi-samples with large-scale imaging and multiplexed post staining. Commun Biol. 2023;6(1):148. Published 2023 Feb 3. doi:10.1038/s42003-023-04456-3
下一页:
2023
/
02-16
所属分类:
学术进展
新闻中心
相关资讯—

